|
|
供應(yīng) 利那洛肽 /851199-59-2  |
規(guī) 格: |
|
價 格: |
面議/ |
數(shù) 量: |
1 |
交貨地: |
|
發(fā)布時間: |
2016-11-07 |
有效期: |
255天 |
備 注: |
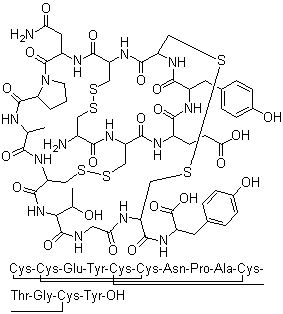
藥品名稱:利那洛肽
英文名稱:Linaclotide
商品名:Linzess
劑型規(guī)格:膠囊 145μg和290μg
分子式:C59H79N15O21S6
分子量:1526.8
CAS.NO:851199-59-2
注冊類別:化3+3類
適應(yīng)癥:用于治療便秘腸易激綜合癥(IBS-C)和慢性特發(fā)性便秘(CIC)��。
產(chǎn)品特點(diǎn)及上市信息:
利那洛肽是由美國Ironwood公司研發(fā)�����,于2012年8月30日獲美國FDA批準(zhǔn)上市�����。該藥為膠囊劑�����,用于治療用于治療便秘腸易激綜合癥(IBS-C)和慢性特發(fā)性便秘(CIC)��,它是首個具有此種作用機(jī)制的治療便秘的藥物��。
利那洛肽是一種鳥苷酸環(huán)化酶C激動劑���,它與腸道GC-C結(jié)合后����,導(dǎo)致細(xì)胞內(nèi)和細(xì)胞外鳥苷酸(cGMP)濃度升高����。細(xì)胞內(nèi)cGMP升高可以刺激腸液分泌�,加快胃腸道移行,從而增加排便頻率���;細(xì)胞外cGMP濃度升高會降低痛覺神經(jīng)的靈敏度�、降低腸道疼痛��。
利那洛肽在IBS-C患者中應(yīng)用的安全性和有效性在兩項隨機(jī)雙盲研究中得到了肯定����,這兩項研究納入了1604例受試者。試驗(yàn)中�,患者隨機(jī)分入290μg利那洛肽治療組和安慰劑組,治療至少12周����。結(jié)果顯示,與安慰劑相比����,利那洛肽在患者腹痛和增加完全自發(fā)排便次數(shù)(CSBMs)方面較安慰劑更有效�。這兩項IBS-C研究計劃在2012年10月份《美國胃腸病學(xué)雜志》發(fā)表���。進(jìn)一步開展的兩項雙盲���、多中心臨床試驗(yàn)確定了利那洛肽在慢性特發(fā)性便秘患者中的安全性和有效性,研究納入了1272例慢性便秘患者�。這兩項研究于2011年發(fā)表在新英格蘭醫(yī)學(xué)雜志,醫(yī)景醫(yī)療新聞(Medscape Medical News)曾對此做過報道����。在這兩項研究中,患者隨機(jī)分入安慰劑組����、利那洛肽145μg/d組或利那洛肽290μg/d組。治療12周后����,達(dá)到主要終點(diǎn)(每周完全自發(fā)的排便(CSBM) ≥ 3 次,以及在12 周中的至少有9周CSBM 比基線增加 ≥ 1 次)�����,利那洛肽145 μg治療組達(dá)到終點(diǎn)的患者數(shù)顯著性高于安慰劑組。
專利及知識產(chǎn)權(quán)信息: WO2012034068 WO2012021715
WO2011103311 WO2011056850 WO2011020054
WO2011019819 WO2011017502 WO2010115916
WO2010019266 US20100152118 US20100125056
研發(fā)進(jìn)度:待申報
合作方式:委托開發(fā)���、聯(lián)合開發(fā) |
結(jié)構(gòu)式: |
 |
|
|

