|
|
供應(yīng) 伊立替康原料及脂質(zhì)體注射液技術(shù)轉(zhuǎn)讓 /97682-44-5  |
規(guī) 格: |
43 mg/10 mL |
價(jià) 格: |
面議/ |
數(shù) 量: |
面議 |
交貨地: |
|
發(fā)布時(shí)間: |
2016-11-23 |
有效期: |
3天 |
備 注: |
伊立替康原料及脂質(zhì)體注射液
【通用名】伊立替康原料及脂質(zhì)體注射液
【原研商】MERRIMACK PHARMS
【商品名】ONIVYDE
【英文名】Irinotecan
【漢語拼音】Yilitikang
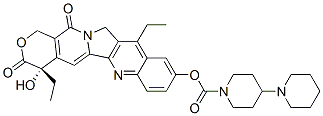
【化學(xué)名】 4S-4,11-二乙基-4-羥基-9[(4-哌啶基哌啶)羰基]-1H 吡喃[3’,4’:6,7]吲哚嗪[1,2-b]喹啉-3,14(4H,12H)-二酮鹽酸鹽
【CAS號(hào)】97682-44-5
【申報(bào)分類】化藥3類
【劑型及規(guī)格】脂質(zhì)體注射劑���; 43 mg/10 mL
【分子式】 C33H38N4O6•HCl•3H2O
【分子量】677.19
【成 份】本品主要成份為伊立替康
【適應(yīng)癥】 用于在基于吉西他濱的治療后的轉(zhuǎn)移性胰腺癌患者
【用法用量】
(1)ONIVYDE的推薦劑量為每?jī)芍?0mg/m2靜脈輸注90分鐘。
(2)在UGT1A1 * 28純合子患者中推薦的ONIVYDE起始劑量為每?jī)芍?0mg/m2����。
(3)對(duì)于血清膽紅素高于正常上限的患者,沒有推薦劑量的ONIVYDE�。
(4)服用ONIVYDE30分鐘前服用皮質(zhì)類固醇和止吐藥。
【國(guó)內(nèi)外獲批信息】
Merrimack制藥公司(前身是HERMES Biosciences)授權(quán)Shire在和PharmaEngine公司共同開發(fā)并推出了伊立替康脂質(zhì)(MM-398)�����。2015年5月被批準(zhǔn)在歐洲上市����,2015年10月被批準(zhǔn)在美國(guó)上市。目前國(guó)內(nèi)未上市伊立替康脂質(zhì)體注射液��。
二���、項(xiàng)目特點(diǎn)
1.在人體內(nèi)具有無毒�����、無免疫原性�,可降解、緩釋等特點(diǎn)�;
2.能夠增強(qiáng)所載藥物在人體內(nèi)的穩(wěn)定性和藥理作用,使藥物穩(wěn)定抵達(dá)靶組織后釋放���,減少所需藥量���,降低毒副作用;
3.小單室脂質(zhì)體在治療腫瘤時(shí)具有被動(dòng)靶向特性����,還可制成免疫脂質(zhì)體實(shí)現(xiàn)主動(dòng)靶向性;
4.由于脂質(zhì)體的親水和親脂兩重特性�,能夠攜帶脂溶性藥物通過血液循環(huán)到達(dá)靶組織,彌補(bǔ)一些重要脂溶性藥物不溶于水的缺陷�����;
5. FDA在審評(píng)期間授予了伊立替康脂質(zhì)體注射液優(yōu)先審評(píng)及孤兒藥資格�����。
三��、市場(chǎng)前景
統(tǒng)計(jì)數(shù)據(jù)顯示,我國(guó)癌癥發(fā)病率過去30年間增長(zhǎng)了80%�����,癌癥已成為我國(guó)因疾病死亡的第一大死因�。與西方國(guó)家相比,我國(guó)胰腺癌總體發(fā)病率略低�,但人口基數(shù)大���,并且治療及化療用藥水平與國(guó)外有一定差距����。
2012年��,國(guó)內(nèi)16個(gè)重點(diǎn)城市樣本醫(yī)院抗腫瘤��、免疫增強(qiáng)及支援藥總體市場(chǎng)規(guī)模達(dá)到158億元����,比上一年增長(zhǎng)17.75%。由于抗腫瘤藥物適應(yīng)癥的多靶點(diǎn)特征����,其中可用于胰腺癌化療藥物的市場(chǎng)已達(dá)到15億元�,占醫(yī)院腫瘤化療市場(chǎng)的10%�,比上一年增長(zhǎng)12.69%。
四��、知識(shí)產(chǎn)權(quán)情況
無專利限制
五�、項(xiàng)目進(jìn)度
已完成臨床前藥學(xué)研究,工藝成熟�����,可隨時(shí)對(duì)外進(jìn)行技術(shù)轉(zhuǎn)讓
六���、合作方式
技術(shù)轉(zhuǎn)讓���,合同標(biāo)的為拿到生產(chǎn)批件。
|
結(jié)構(gòu)式: |
 |
|
|

